Sự phân hủy của ozone và khử ozone dư
Sự Phân Hủy Của Ozone Và Phương Pháp Khử Ozone Dư
Phân hủy ozone (O3 → O2) sau khi sử dụng là bước quan trọng nhằm loại bỏ lượng ozone dư trước khi xả ra môi trường, vì ozone được coi là khí độc nếu tồn tại ở nồng độ cao.
1. Sự Phân Hủy Ozone
Ozone là một phân tử không bền, dễ tự phân hủy thành oxy, đặc biệt khi nhiệt độ tăng cao. Phản ứng phân hủy ozone là một phản ứng tỏa nhiệt (exothermic reaction) xảy ra tự phát với enthalpy ΔH (25°C) = -138 kJ/mol (theo Perry & Green, 1997).
Phản ứng cơ bản: O3 → O2 + O1 → O2
Trong điều kiện tự nhiên, ozone trong không khí ở 20°C có thể tồn tại khoảng 2 ngày, trong nước ở 35°C tồn tại khoảng 8 phút. Nhiệt độ, độ pH, các ion (OH-, NO, Cl) và tia UV là các yếu tố ảnh hưởng lớn đến tốc độ phân hủy ozone.

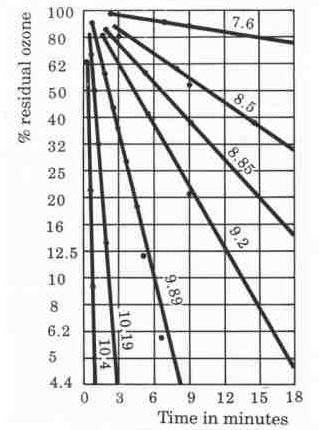
Hình 4.15: Tốc độ phân hủy ozone theo thời gian trong các loại nước khác nhau. Nước càng sạch, tốc độ phân hủy ozone càng chậm. (Nguồn: Leentech)
2. Các Yếu Tố Ảnh Hưởng Đến Sự Phân Hủy Ozone
2.1 Nhiệt Độ
Nhiệt độ càng cao, ozone càng phân hủy nhanh. Trên 40°C, ozone không được khuyến khích sử dụng vì tốc độ phân hủy quá nhanh.
2.2 Độ Kiềm (pH)
Ozone nhạy cảm với pH. pH càng cao (môi trường kiềm), ozone càng dễ bị phân hủy do phản ứng với ion OH-.
2.3 Loại Nước
- Nước cất hai lần: Tốc độ phân hủy ozone rất chậm.
- Nước máy: Tốc độ phân hủy trung bình.
- Nước ao, nước sông: Ozone phân hủy nhanh do chứa nhiều tạp chất hữu cơ và vi sinh vật.

Hình 4.16: Sự phân hủy ozone trong nước ao và nước máy. Thời gian bán phân hủy tăng theo độ sạch của nước. (Nguồn: VJC, 2018)
2.4 Phản Ứng Với Ion Hydroxyt
Các phản ứng hóa học tiêu biểu:
- O3 + OH- → HO2- + O2
- O3 + HO2- → *OH + O2*- + O2
Các gốc tự do *OH và O2*- tiếp tục phản ứng, tạo ra OH- mới, thúc đẩy quá trình tiêu hao ozone.

Hình 4.17: Tốc độ phân hủy ozone phụ thuộc vào độ pH. pH càng cao, tốc độ phân hủy ozone càng nhanh. (Nguồn: Leentech)
3. Phương Pháp Khử Ozone Dư
Ozone dư cần được loại bỏ sau khi sử dụng để đảm bảo an toàn. Một số phương pháp khử ozone dư hiệu quả bao gồm:
3.1 Khử Ozone Dư Bằng Chất Xúc Tác
Sử dụng chất xúc tác như MnO2, CuO, Pt/γ-Al2O3 để phân hủy nhanh ozone dư. Tham khảo thêm tại Khử ozone dư bằng chất xúc tác.
3.2 Khử Ozone Dư Bằng Than Hoạt Tính
Than hoạt tính giúp hấp phụ và phân hủy ozone một cách hiệu quả trong hệ thống xử lý khí thải.
3.3 Khử Ozone Dư Bằng Nhiệt
Gia nhiệt dòng khí chứa ozone để thúc đẩy phản ứng phân hủy nhanh chóng.
3.4 Khử Ozone Dư Bằng UV
Sử dụng tia UV để phá vỡ liên kết ozone, chuyển hóa thành oxy.
4. Ứng Dụng Thực Tế
Trong các hệ thống máy ozone công nghiệp, khử ozone dư là bước bắt buộc nhằm đảm bảo an toàn cho người vận hành và môi trường xung quanh. Các thiết bị khử ozone dư chuyên dụng hiện nay thường tích hợp sẵn trong hệ thống xử lý khí.
Quý khách có thể tham khảo thêm các thiết bị tại: Máy khử ozone dư và phụ kiện ozone trên website của chúng tôi.
5. Kết Luận
Sự phân hủy của ozone là một quá trình tự nhiên và quan trọng trong việc đảm bảo an toàn trong quá trình sử dụng ozone. Việc kiểm soát và khử ozone dư là yêu cầu bắt buộc đối với các hệ thống sử dụng ozone trong công nghiệp, xử lý nước và không khí.
Liên Hệ Tư Vấn
Hotline: 0918534363 - 0912534363
Email: O3bkidt@gmail.com
Website: thietbibkidt.vn